
8.2 ASİT BAZ VE PH ÇİZELGESİ CANLI YAYIN TEKRARI YouTube
Asit ve Bazların Tahribatları Asitler ve bazlar tahriş edici (aşındırıcı) özelliğe sahiptir. Asit ve bazları kullanırken, taşırken dikkatli olmamız gerekir. Laboratuvar, mutfak, banyoda kullanılan asit ve bazların etkilerinden korunmak için eldiven takılmalı, gözlük kullanılmalıdır.

8 Sınıf Asitler ve Bazlar (Animasyonlu ve Detaylı Anlatım) En doğru
öğreneceksiniz. Asit ve bazlar yaşamın olduğu çoğu alanda bulunur ve kontrolden çıkmadıkça yararlıdırlar. İnsan vücudu kontrolün bozulmaması için vücudun pH seviyesini istenen düzeyde tutmaya çalışır. Soluduğumuz havanın kalitesi de vücudun pH dengesini sağlamak için önemlidir. Günümüzde havaya salınan asidik.
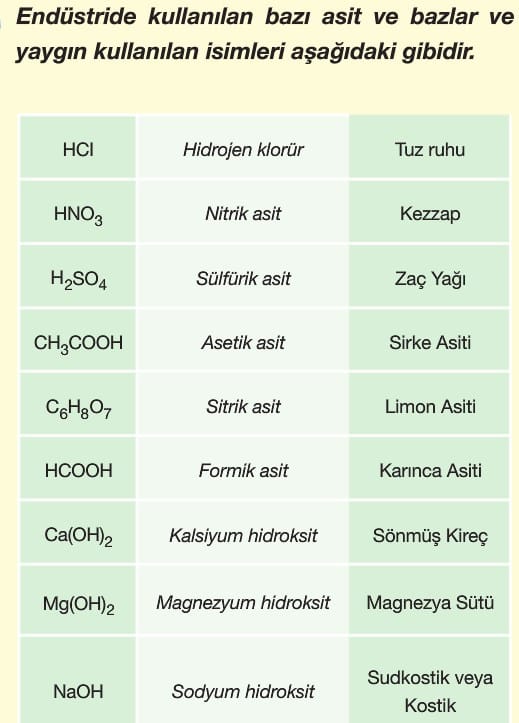
Asit ve Bazların Kullanım Alanları Özellikleri Kimya Tyt Konu
Asitler Bazlar ve Tuzlar Asit Nedir; Sulu çözeltilerinde hidrojen iyonu (H+) verebilen maddelere denir. Mesela hidroklorik asit olan HCL suda çözününce H+ Cl elde edilir. Yani H+ iyonu meydana gelmiş olur. İşte bu maddelerin özellikler şunlardır; Sudaki çözeltilerine H+ iyonu verirler. Seyreltik çözeltilerinin tadı ekşidir.

Asitler Ve Bazlar Konu Anlatımı Nedir
8. Sınıf LGS Fen Bilimleri Madde ve Endüstri ünitesi kapsamında asitler ve bazları öğreniyoruz. Asit ve bazların genel özellikleri tartışıyoruz.Asit ve bazla.

Asitler ve Bazlar Konu Anlatımı 8.Sınıf Konu Anlatımları
Asitler ve Bazlar konusu 8. Sınıf 4. Ünitenin dördüncü konusudur. F.8.4.4. Asitler ve Bazlar Önerilen Süre: 8 ders saati Konu / Kavramlar: Asit, baz, pH, asit yağmurları, asit yağmurlarına karşı çözüm önerileri Kazanımlar F.8.4.4.1. Asit ve bazların genel özelliklerini ifade eder.

Asit ve Bazların Özellikleri (Farkları) Nelerdir? Eğitim
Bu ünite hakkında: Bu ünitede, asit-baz kimyasında kimyasal dengenin rolü işlenir. pH ve pOH, zayıf asit ve bazlar, tamponlar, asit-baz titrasyonları ve daha fazlası hakkında bilgi edinin. 70'in üzerinde AP uyumlu soru ile öğrendiklerinizi pekiştirin ve AP Kimya sınavına hazırlanın.

Asit ve bazlar çalışma kağıdı ve cevap anahtarı
İçindekiler17- ASİTLER ve BAZLAR 66517-1 Asit ve Baz Tanımı-Arrhenius- Kuramı:Sunuş17-2 Asit ve Baz Tanımı Bronsted-Lowry Kuramı17-3 Suyun İyonlaşması ve pH Eşeli17-4 Kuvvetli Asitler ve Bazlar17-5 Zayıf Asitler ve Bazlar17-6 Çok Protonlu Asitler17-7 Asit ve Baz Özelliği Gösteren İyonlar17-8 Molekül Yapısı ve Asit-Baz Davranışı17-8 Lewis Asit ve BazlarıÖzel Konu.

8.SINIF 4.ÜNİTE ASİTLER VE BAZLAR FENOZOM
Asit - baz kavramları, asit - bazların genel özellikleri ve nötrleşme olayı detaylıca anlatılmıştır. Asitler ve bazlar suyla çözeltilerinde iyon veren maddelerin bütünüdür. Günlük hayatta kullandığımız sabun, deterjan, deodorant, temizlik maddeleri, elma, sirke, limon, üzüm ve zeytinyağı gibi daha birçok şey.

PPT Asitler ve Bazlar PowerPoint Presentation, free download ID5357288
Çevremizdeki pek çok maddeyi ortak kimyasal özelliklerine göre gruplandırabiliriz. -. Asitler, bazlar ve tuzlar bu. Folik asit gruplardan üçünü oluşturur. Asitler. Asit kelimesi latince "ekşi" anlamına gelir. Ekşi tat veren maddeler asit özelliğine sahiptir. limonda sitrik asit elmada malik asit.

AsitBazlar ASİT VE BAZLARIN ÖZELLİKLERİ
Asitler ve Bazlar (Acids and Bases)1. Bronsted-Lowry Asit-Baz Tanımı (Brønsted-Lowry Acids and Bases )2. Lewis Asit- Baz Tanımı (Lewis AcIds And Bases)Örnekl.
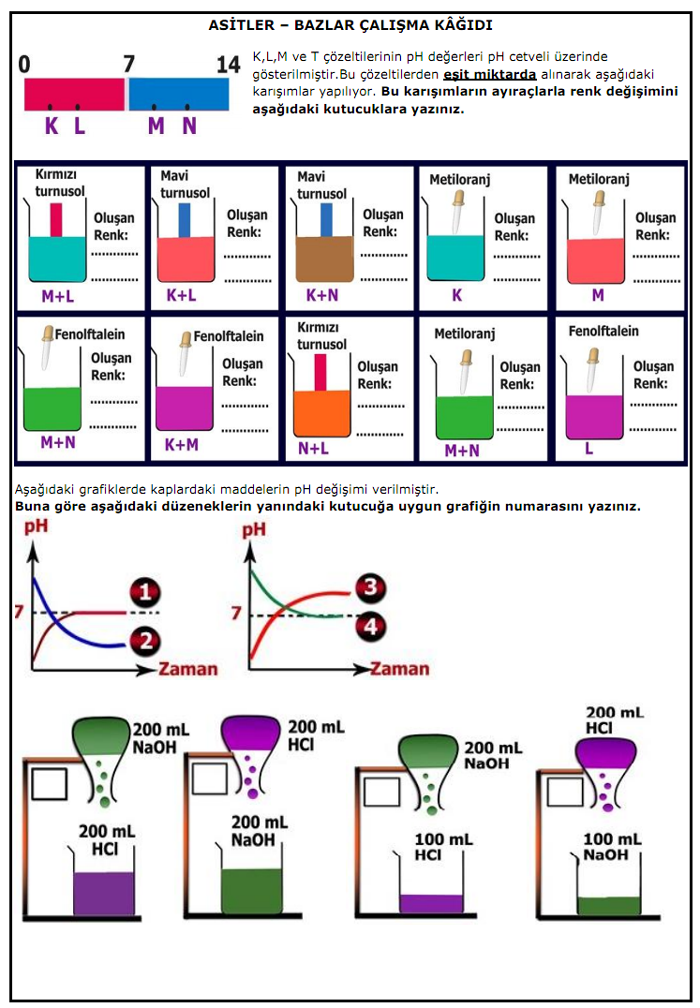
Asit ve bazlar çalışma kağıdı ve cevap anahtarı
Sınıf konularından Asitler ve Bazlar, Asitlerin ve Bazların Değerliği, Kuvvetli Asit ve Bazlar, Nötrleşme Tepkimeleri, Tuzlar hakkında bilmen gerekenler ile TYT sınavında önemli olan 10. sınıf Asit Baz ve Tuzlar konusuna ait soruları çözerken işine yarayacağını düşündüğümüz ipuçları yer alıyor. Umarız bu notlar.
Asit ve bazlar 2
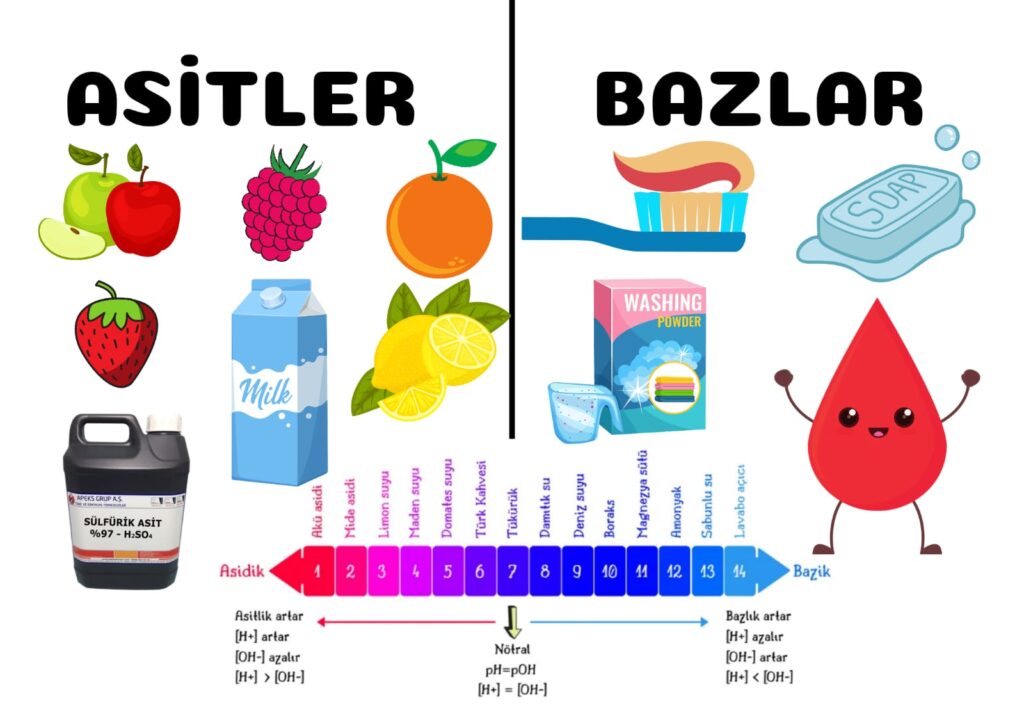
PH Nedir(Asitler ve Bazlar) Bilim adamları pH ölçeğini kullanarak asitleri ve bazları takip ederler. Açılımı "Power of Hydrogen" (Hidrojenin Gücü)'dir. 1909'da Danimarkalı biyokimyacı Sören Sörensen asitliği ölçmek için pH ölçeğini icat etti . PH ölçeği aşağıdaki formülle tarif edilir: pH = -log [H.

8.SINIF ASİTLER VE BAZLAR YouTube
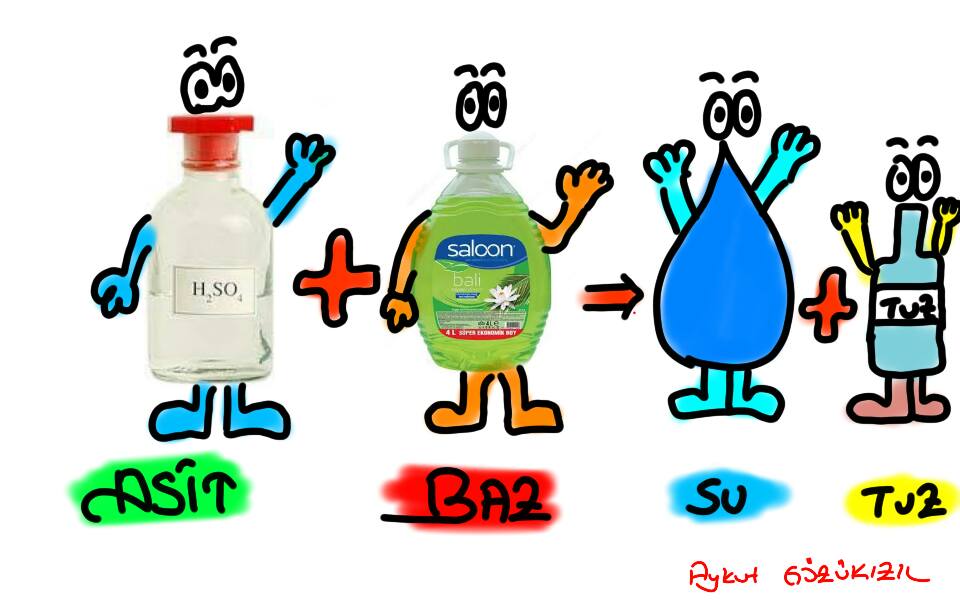
Asit (H +) ve baz (OH -) tepkimeye girerek tuz ortaya çıkmasına neden olurlar. Asit + Baz → Tuz + H2O. Bu durum nötrleşme olarak ifade edilmektedir. Asit maddesinden gelen H + iyonlarının mol sayısı (n) ile baz maddesinden gelen OH- iyonlarının mol sayısı eşitse ortam nötr hale gelir ve pH seviyesi 7 olarak belirlenir.

Asit Ve Bazlar YouTube
C- Asit ve Bazların Tahribatları Asitler ve bazlar tahriş edici (aşındırıcı) özelliğe sahiptir. Asit ve bazları kullanırken, taşırken dikkatli olmamız gerekir. Laboratuvar, mutfak, banyoda kullanılan asit ve bazların etkilerinden korunmak için eldiven takılmalı, gözlük kullanılmalıdır.

2. Asitler, Bazlar ve Tuzlar_1. BÖLÜM Asitler ve Bazlar_2_AsitBaz
pH, pOH ve pH ölçeği. Brønsted-Lowry Asit Baz Kuramı (Teorisi) Asit ve Bazların Bronsted-Lowry Tanımı. Suyun Otoiyonizasyonu. Suyun Otoiyonizasyonu ve Kw. pH Nedir? Kuvvetli Asit Çözeltileri. Kuvvetli Baz Çözeltileri. Asit Kuvveti, Anyon Hacmi ve Bağ Enerjisi.
8.SINIF FEN BİLİMLERİ POSTERLERİ FENUS BİLİM
Asitler, Alkaliler Ve Tuzlar. 37690 okunma. Günlük Hayatta Kullandığımız Asit ve Bazlar hayatımızda kullandığımız hemen hemen tüm gerekli şeylerin içinde yer almaktadır. Olumlu yönleri olduğu gibi olumsuz etkileri de barındırabilen asit ve bazlar, sabun, çamaşır suyu, tuz ruhu, gazoz, sirke ve bazı ilaçların.